ОБНОВЛЕННАЯ ИНФОРМАЦИЯ В СВЯЗИ С ФАКТАМИ ОБНАРУЖЕНИЯ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ ПРИМЕСЕЙ НИТРОЗАМИНОВ
Общие сведения
Впервые о фактах обнаружения примесей нитрозамина (N-нитрозодиметиламина (НДМА)) в препаратах, содержащих валсартан, надзорным органам в области обращения лекарственных средств стало известно в июле 2018 г. Валсартан – лекарственное средство, блокатор рецепторов ангиотензина ІІ (БРА), входящий в группу родственных соединений, известных как сартаны.
В дальнейшем примеси нитрозаминов, в том числе N-нитрозодиэтиламина (НДЭА), N-нитрозодиизопропиламина (НДИПА), N-нитрозоэтилизопропиламина (НЭИПА) и N-нитрозо-N- метил-4-аминобутановой кислоты (НМАК), также были обнаружены в других сартанах. Не
Не так давно было установлено наличие примесей нитрозаминов в препаратах, содержащих пиоглитазон и ранитидин1-3
Что такое нитрозамины?
Нитрозамины (более правильное название – N-нитрозоамины) это вещества, молекулы которых содержат нитрозогруппу. Обнаружение примесей этих веществ вызывает озабоченность, поскольку нитрозамины относятся к группе вероятных канцерогенов для человека. Несмотря на то, что нитрозамины могут присутствовать в ряде продуктов питания или питьевой воде, наличие их примесей в лекарственных препаратах считается недопустимым.
Происхождение примесей нитрозаминов
Как правило, нитрозамины образуются только в результате реакции вторичных или третичных аминов с азотистой кислотой. Азотистая кислота сама по себе нестабильна, но может образовываться in situ в процессе окисления нитритов (NO2).
Большинство сартанов содержат тетразольное кольцо, которое образуется при участии нитрита натрия. При этом присутствие в рассматриваемых препаратах НДМА и НДЭА, как представляется, связано с тем, что при их приготовлении в качестве растворителя использовались амины либо растворители, содержащие примеси аминов. Причины присутствия НДМА в ранитидине пока остаются невыясненными
Тем не менее, в ходе продолжающегося расследования был также сделан вывод о том, что содержание примесей нитрозаминов, возможно, имеет другое объяснение и не является случайным следствием присутствия нитритов и аминов в процессе синтеза активной фармацевтической субстанции (АФС).4
Есть данные о том, что условия для образования нитрозаминов могут также возникать в результате случайного загрязнения нитритами или аминами исходных материалов, реагентов или растворителей; так, диметиламин может присутствовать в качестве примеси в составе диметилформамида (ДМФ) – широко применяемого растворителя. Загрязнение нитритами или аминами на последующих этапах производства препаратов также может создать условия для образования нитрозаминов. В частности, было установлено, что одной из причин наличия в препаратах примесей нитрозаминов была контаминация из внешних источников. В ряде случаев это было вызвано повторным использованием некоторых материалов или растворителей, содержавших в своем составе нитрозамины. Описан случай повторного использования ДМФ, для очистки которого от остаточных азидов применялся нитрит натрия. Кроме того, для обработки материалов и растворителей в целях вторичного использования часто привлекаются сторонние предприятия, которые не всегда должным образом контролируют состав своей продукции. Материалы или растворители могут быть загрязнены нитрозаминами или другими примесями, из которых в дальнейшем могут образоваться нитрозамины, в результате перекрестной контаминации, если оборудование таких предпритий не проходит надлежащую очистку между партиями материалов, поступающими от разных заказчиков4b
Важно отметить, что эти дополнительные факторы загрязнения нитрозаминами, в частности перекрестная контаминация, не являются специфичными для каких-либо конкретных видов продукции и могут затрагивать препараты, в которых при нормальных условиях нитрозамины не образуются. Беспокойство относительно потенциального масштаба проблемы побудило Европейское агентство по лекарственным средствам (ЕМА)5обратиться ко всем держателям регистрационных удостоверений на готовые лекарственные средства с просьбой провести оценку риска контаминации их продукции нитрозаминами.
Токсичность
НДМА и НДЭА относятся к группе сильнодействующих мутагенных канцерогенов, которые по классификации Международного агентства ВОЗ по исследованию рака являются возможными канцерогенами для человека. Несмотря на сильнодействующий канцерогенный характер этих веществ, риск того, что примеси нитрозаминов в обнаруженных концентрациях могут вызвать рак у человека, является очень низким.
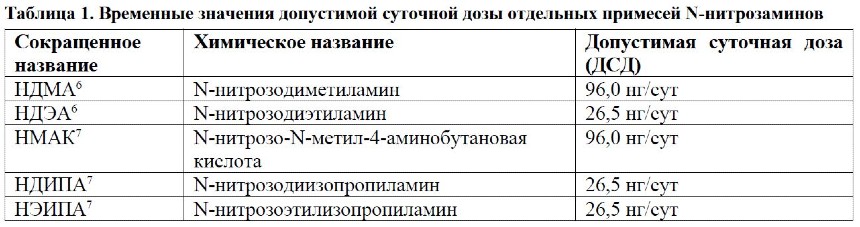
Специфичных токсикологических данных о примесях НДМА и НДЭА очень мало. На основе имеющейся информации большинством крупнейших органов регулирования были установлены временные значения допустимой суточной дозы примесей указанных веществ (см. таблицу 1).
По мнению международных органов регулирования, по своим токсикологическим характеристикам НДИПА, НЭИПА и НМАК аналогичны НДМА и НДЭА ввиду их структурного сходства.
Для расчета допустимой суточной дозы примесей нитрозаминов, не указанных в таблице 1, рекомендуется следовать принципам, изложенным в руководстве МКГ M7(R1)8. Анализ по меньшей мере одного аналога валсартана, содержавшего нитрозамины, с использованием теста Эймса дал отрицательный результат.4
Действия органов регулирования
В Европейском союзе (ЕС) после проведения в соответствии со статьей 31 обзора сартанов, которые могут содержать примеси нитрозаминов (т.е. сартанов, молекулы которых содержат тетразольное кольцо)9, производителям было предложено проанализировать свои производственные процессы и внести в них изменения для снижения содержания в продукции примесей нитрозаминов настолько, насколько это практически осуществимо. На внесение этих изменений производителям дан срок в два года. В течение переходного периода к производимым ими препаратам будут применяться временные значения ДСД, указанные в таблице 1. Серии препаратов, содержащие один из нитрозаминов в количестве, превышающем установленный допустимый уровень, либо содержащие как НДМА, так и НДЭА, запрещены к обращению на территории ЕС.
В монографии Европейской фармакопеи по лекарственным веществам, относящимся к группе сартанов, вносятся изменения для включения в них положений о тестировании на примеси нитрозаминов. В дополнение к этому идет пересмотр общей монографии по АФС (Общая монография 2034), в которую также будут внесены указания относительно такого тестирования.
В результате принятия этих мер в ЕС был временно отозван целый ряд препаратов группы сартанов. В настоящее время многие из них вновь были допущены к обращению; при этом ЕС рекомендовал пациентам не прерывать курс лечения этими препаратами без соответствующих указаний со стороны фармацевта или лечащего врача.
Аналогичным образом, Управление США по надзору за качеством пищевых продуктов и лекарственных средств (FDA) приняло меры по выявлению и отзыву лекарственных средств, содержащих нитрозамины в концентрации, превышающей допустимый уровень. FDA опубликовало список блокаторов рецепторов ангиотензина с указанием информации о содержании в них нитрозаминов10 Как и EMA, FDA подчеркнуло, что риск (например, инсульта), связанный с резким прекращением приема этих препаратов, намного превышает риск, связанный с продолжением их приема даже в случае наличия в них примесей нитрозаминов.
Совсем недавно некоторое количество примесей НДМА было обнаружено в нескольких сериях ранитидина и низатидина. Ранитидин широко используется как средство снижения секреции соляной кислоты в желудке при лечении таких заболеваний, как изжога или язва желудка. Этот препарат реализуется как без рецепта, так и по рецепту.
Реакция органов регулирования была разной. Так, в качестве меры предосторожности органы регулирования некоторых европейских стран, а также институт Swissmedic (орган регулирования в сфере обращения лекарственных средств Швейцарии) и агентство Health Canada отзозвали или приостановили реализацию всех препаратов на основе ранитидина до получения данных о том, что содержание в них НДМА находится ниже допустимого уровня. В настоящее время ЕМА проводит оценку имеющихся данных для определения уровня риска, которому пациенты, принимающие ранитидин, могут быть подвержены в связи с наличием в препарате примесей НДМА11.11
Другие органы регулирования, например, FDA потребовали от производителей добровольно отзывать свою продукцию только в случае, если по результатам анализа содержание в них НДМА превысит временные допустимые значения12 По данным FDA, по содержанию НДМА большинство препаратов на основе ранитидина и низатидина сопоставимы с такими обычными продуктами питания, как жареное или копченое мясо.
Многие фармацевтические компании в качестве превентивной меры в добровольном порядке отозвали производимые ими лекарственные средства на основе ранитидина.
качестве общей меры ЕМА потребовало от всех держателей регистрационных удостоверений на готовые лекарственные средства выполнения оценки вероятности присутствия нитрозаминов во всех препаратах, содержащих химически синтезированные активные вещества5 Причиной такой меры предосторожности стало то обстоятельство, что несмотря на отсутствие условий для образования нитрозаминов в процессе производства подавляющего большинства лекарственных средств, вероятность перекрестной контаминации или наличия в препаратах случайных примесей аминов и нитритов полностью исключить нельзя. Эта оценка должна носить широкий характер и касаться всех этапов производственного процесса, включая производство готовых лекарственных средств. Согласно требованию ЕМА держатели регистрационных удостоверений должны выполнить эту оценку в шестимесячный срок.
Методы тестирования
Ввиду низкой концентрации примесей нитрозаминов их обнаружение является трудной задачей. Для помощи в выполнении лабораторного анализа FDA опубликовало несколько методических руководств, которые могут использоваться при определении концентрации нитрозамина в АФС или готовых лекарственных средствах.
https://www.USFDA.gov/media/124025/download
https://www.USFDA.gov/media/115965/download
https://www.USFDA.gov/media/130801/download
https://www.USFDA.gov/media/131868/download
FDA рекомендует для тестирования ранитидина использовать метод ЖХ-МСВР, который позволяет работать при более низких температурах; более высокие температуры, необходимые для выполнения лабораторного анализа другими методами, могут привести к образованию НДМА в тестируемых образцах.13
Сеть официальных лабораторий по контролю за лекарственными средствами Совета Европы также опубликовала ряд методических руководств, которые могут использоваться для лабораторного анализа на предмет определения концентрации нитрозаминов. Эти документы размещены по адресу:
https://www.edqm.eu/en/ad-hoc-projects-omcl-network
Рекомендации
В отношении сартана, ранитидина и других препаратов, в которых были обнаружены примеси нитрозаминов, органам регулирования рекомендуется принять следующие меры:
- провести проверку на предмет наличия примесей нитрозаминов в находящихся в обращении препаратах этой группы либо на базе национальных контрольных лабораторий, либо на основе данных производителей; для лабораторного анализа должны использоваться надлежащие методы;
- обратиться к держателям регистрационных удостоверений на лекарственные средства этой группы с требованием выполнить оценку риска с целью выявления причин контаминации нитрозаминами и установить предельные значения концентрации нитрозаминов в лекарственных препаратах для проведения контрольных мероприятий;
- обратиться к держателям регистрационных удостоверений с требованием принять необходимые меры по обеспечению отсутствия нитрозаминов в их продукции.
В качестве временной меры рекомендуется за предельно допустимые значения принимать значения, указанные в таблице 1, которые были рассчитаны на основе наилучшей имеющейся информации. Для определения суточной дозы других нитрозаминов, не указанных в таблице 1, рекомендуется следовать принципам, изложенным в руководстве МКГ M7(R1)8.
Расследования случаев присутствия примесей нитрозаминов в лекарственных препаратах показали, что для полноценного анализа риска контаминации нитрозаминами готовых лекарственных средств недостаточно изучить только проблему одновременного использования нитритов и аминов при получении активной фармацевтической субстанции. Производители всех готовых лекарственных средств при оценке своей продукции должны учитывать любые факторы и обстоятельства, которые могут способствовать случайному попаданию нитрозаминов в лекарственные средства, и принимать меры по снижению этого риска. В требовании ЕС к производителям фармацевтической продукции5 содержится подробное описание подлежащих учету факторов.
В случае, если содержание какого-либо нитрозамина в препарате находится ниже временного максимального допустимого значения, такой препарат, как правило, считается безопасным и может оставаться в обращении.
Если же содержание нитрозамина в препарате превышает допустимые пределы или в препарате присутствует более одного нитрозамина, такой препарат, как правило, не должен быть допущен к обращению. Однако при принятии такого решения каждый национальный орган регулирования должен действовать сбалансированно и учитывать потенциальное негативное воздействие на пациентов, которые могут остаться без доступа к лечению. Для этого необходимо проверить наличие в обращении аналогичных лекарственных средств других производителей или альтернативных методов лечения, а также изучить клинические последствия прекращения приема одного и начала приема другого препарата.
До настоящего момента во всех случаях пациентам рекомендовалось не прерывать курс лечения без соответствующих на то указаний со стороны лечащего врача.
ВОЗ будет продолжать следить за ситуацией вокруг контаминации лекарственных средств нитрозаминами и публиковать обновленную информацию по мере ее поступления. Также рекомендуется следить за публикациями на сайтах FDA и EMA, где по итогам текущих расследований будет размещаться обновленная информация.
Справочная литература
2 - https://www.ema.europa.eu/en/news/ema-review-ranitidine-medicines-following-detection-ndma
5 - https://www.ema.europa.eu/en/news/ema-advises-companies-steps-take-avoid-nitrosamines-human-medicines
6 - February 2019, EMA/44960/2019: Sartan medicines: companies to review manufacturing processes to avoid presence of nitrosamine impurities.
9 - 20 August 2019 EMA/351053/2019 rev 1: Temporary interim limits for NMBA, DIPNA and EIPNA impurities in sartan blood pressure medicines.
8 - https://database.ich.org/sites/default/files/M7_R1_Guideline.pdf
11 - https://www.ema.europa.eu/en/medicines/human/referrals/ranitidine-containing-medicinal-products
12 - https://www.USFDA.gov/drugs/drug-safety-and-availability/laboratory-tests-ranitidine.
WHO Global Surveillance and Monitoring System
for Substandard and Falsified Medical Products
For further information, please visit: http://covid.comesa.int/medicines/regulation/ssffc/en/
